科学家阐明人TRPM2通道结构及其激活机制
发布时间:2019-01-09 14:38:17 | 来源:《中国生物技术发展中心网站》2019年1月9日
近日,哈佛医学院科研人员在Science杂志上发表了题为“Structures and gating mechanism of human TRPM2”的文章。他们利用冷冻电镜技术,对3种不同结合态的TRPM2蛋白进行了结构解析,进而阐明了TRPM2离子通道的激活机制,为进一步了解其他TRP通道的激活机制提供理论基础。
TRPM2,即瞬时受体电位M2通道,是Ca2+透过的非选择性阳离子通道,该通道介导人的多种生理病理过程,包括炎症反应和神经退行性疾病等。之前的研究表明,TRPM2通道由ADPR(腺苷二磷酸核糖)和Ca2+共同激活,但具体机制仍不明确。
研究人员为了阐明人TRPM2的激活机制,解析了不同状态下的人TRPM2的蛋白结构。通过优化蛋白表达及纯化过程,利用人HEK293F细胞获得了同源重组的TRPM2蛋白。利用冷冻电镜技术分别解析了3种结合态的TRPM2蛋白,包括:非结合态的TRPM2、与ADPR结合态的TRPM2、与ADPR和Ca2+共结合态的TRPM2,分辨率分别为3.6 Å、6.1 Å和6.4 Å。
研究发现TRPM2是一种具有三层结构的四聚体蛋白,与TRPM家族中其他蛋白的结构相似。底层由C端的NUDT9H结构域,N端的MHR1/2和MHR3结构域,以及极端螺旋组成;中间层由MHR4结构域和蛋白螺旋组成;顶层由S1至S6等6个跨膜螺旋、TRP螺旋及TRP H1结构域组成。非结合态TRPM2上的NUDT9H结构域可以感测ADPR,并且NUDT9H与MHR结构域之间具有广泛的相互作用。在结合ADPR后,NUDT9H和MHR1/2结构域之间发生27°刚体转动,破坏了NUDT9H和MHR间的反式相互作用并且可以引导通道打开。ADPR和Ca2+与TRPM2结合后,使细胞质中的结构域发生15°转动,并伴随TRP螺旋倾斜和S6激活螺旋扭转,进而打开通道。上述发现阐明了TRPM2通道激活的分子机制(见下图)。
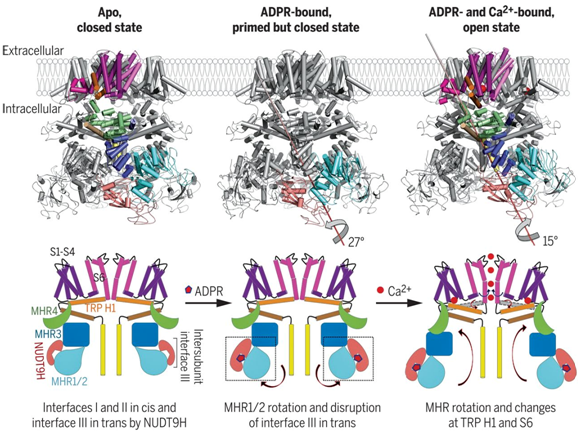
人TRPM2通道激活机制
此外,他们发现种间的TRPM2激活机制存在以下差异:(1)人TRPM2的ADPR结合位点位于NUDT9H结构域,而斑马鱼的结合位点位于MHR1/2结构域;人TRPM2对ADPR的亲和力远高于斑马鱼中的情况;虽然人MHR1/2结构域中对应斑马鱼ADPR结合位点的氨基酸序列发生突变,但并不影响TRPM2通道的打开。(2)人NUDT9H结构域中存在起反式相互作用的P环结构,而斑马鱼中并无此结构。(3)人NUDT9H结构域结合ADPR并促进TRPM2通道打开,但不水解ADPR;而海葵的NUDT9H结构域能够水解ADPR,但无法使TRPM2通道打开。这些物种特异性反映了TRPM2和TRP蛋白超家族在进化过程中功能和作用机制的复杂性。(摘译自Science,Published: 21 December 2018)





