2018年FDA批准新药看点速览 李敏华
发布时间:2019-01-21 13:50:02 | 来源:来源:医药经济报 日期:2019.1.17
2018年FDA批准的新药总计59个,其中绝大多数产品是以前从未用于临床实践的创新产品。少数则是与先前批准的产品或相关产品,拓展了新的治疗领域,譬如2018年5月16日批准的lofexidine hydrochloride(盐酸洛非西定),原为抗高血压药,现被用于成人阿片类药物戒断症状治疗,为非阿片类戒断药,商品名Luceniyra。利福霉素(rifamycin)原为抗结核药,2018年11月16日被批准用于旅行者的腹泻治疗,商品名Aemcolo。
获准药品中,单克隆抗体(12个)、酶制剂等生物技术产品占据半壁江山。
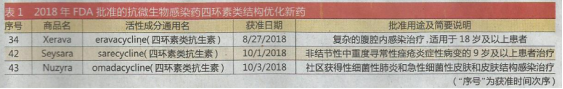
从治疗领域看,主要特点有:类别比较分散;肿瘤治疗及相关药物有9个;罕见病用药占很大比重;抗微生物感染药四环素类结构优化出现了3个新药(见表1)。
此外,新药中不乏潜在的重磅产品。说Biktarvy、Symdeko、Erleada、Aimovig、Epidiolex、Orilissa、Onpattro、Takhzyro、Libtayo、Ultomiris是被全球信息机构科睿唯安(Clarivate Analytics)看好的品种(具体情况见表2)。

还值得关注的有,超越Tamiflu(达菲,Oseltamivir,奥司他韦)的流感药Xofluza(baloxavir marboxil);用于遗传性转甲状腺素介导的成人淀粉样变性多发性神经病治疗的反义药物Tegsedi(inotersen);用于间日症原虫症疾根治(预防复发)的Krintafel(Tafenoquine,他非诺查)。





